Wetenschappelijke publicatie
Meer dan de helft van de mensen met aanhoudende pijn hebben moeite met in- en/of doorslapen. Slaapproblemen worden dikwijls onbehandeld gelaten in de pijnrevalidatie, terwijl goed slapen bijdraagt aan herstel. Deze studie toont aan dat een korte slaapmodule, gebaseerd op cognitieve gedragstherapie voor insomnie (CGT-I), de slaapkwaliteit verbetert en ook helpt bij het omgaan met vermoeidheid. Deze slaapmodule is een laagdrempelige én effectieve toevoeging op de reguliere behandeling.
Auteurs
DR. N. (NIKITA) FRANKENMOLEN
Klinisch neuropsycholoog en senior onderzoeker, Klimmendaal Revalidatiespecialisten Arnhem
S. (SJOERD) VAN LEEUWEN MSC
Gezondheidszorgpsycholoog in opleiding, Vincent van Gogh voor Geestelijke Gezondheidszorg
L. (LOUISE) PILON MSC
Klinisch neuropsycholoog in opleiding en promovendus, Vincent van Gogh voor Geestelijke Gezondheidszorg
R.D. (ROBERT) VAN DER VEEN MSC
Onderzoeker en docent Ergotherapie Lectoraat Neurorevalidatie – Eigen Regie en Participatie Hogeschool van Arnhem en Nijmegen
DR. D. (DIRK) BERTENS
Klinisch neuropsycholoog en hoofd onderzoekslijn cognitieve revalidatie, Klimmendaal Revalidatiespecialisten Arnhem; Principal Investigator Radboud Universiteit Nijmegen, Donders Institute for Brain, Cognition and Behaviour, Nijmegen
Slaapproblemen komen veelvuldig voor bij patiënten met aanhoudende pijn en kunnen de kwaliteit van leven en het psychosociaal functioneren aanzienlijk verminderen. Onderzoek toont aan dat tussen de 50% en 88% van deze patiënten slaapproblemen ervaren, met name insomnie.1 Insomnie wordt niet alleen in verband gebracht met een lagere levenskwaliteit,2 maar ook met verhoogde pijngevoeligheid,3 vermoeidheid,4 angst,5 en depressie.6 De relatie tussen aanhoudende pijn en slaap is bovendien wederkerig: pijn verstoort de slaap, terwijl slaapproblemen de pijntolerantie verlagen,7 waarmee een vicieuze cirkel gecreëerd wordt.3
Cognitieve gedragstherapie voor insomnie (CGT-i) wordt beschouwd als de gouden standaard voor de behandeling van slapeloosheid, ook bij patiënten met aanhoudende pijn.8, 9,10 CGT-i verbetert de slaapkwaliteit, en heeft positieve effecten op vermoeidheid, stemming en dagelijkse functioneren.8, 11,12 Echter, binnen bestaande interdisciplinaire revalidatieprogramma’s wordt CGT-i niet standaard toegepast. Dit hangt samen met de relatief grote tijdsinvestering en de benodigde inzet van een psycholoog.

Om deze belangrijke toepassing toch te realiseren, is een kortdurende, protocollaire slaapmodule ontwikkeld. De revalidatieslaapmodule richt zich primair op het optimaliseren van slaapgedrag, en is aanvullend op bestaande revalidatie-interventies. De ontwikkelde interventie bevat kerncomponenten van CGT-i, zoals psycho-educatie, slaaphygiëne, slaaprestrictie en stimuluscontrole, en kan gegeven worden door een getrainde ergotherapeut.
Het doel van deze studie is om de effectiviteit van de slaapmodule te onderzoeken in aanvulling op de reguliere revalidatiebehandeling bij mensen met aanhoudende pijn. De primaire uitkomstmaat is slaapkwaliteit, en secundaire uitkomstmaten zijn vermoeidheid, disfunctionele overtuigingen over slaap, en symptomen van angst, depressie en pijn. Een tegelijk lopende studie naar de slaapmodule binnen de populatie met niet-aangeboren hersenletsel (NAH) heeft aangetoond dat deze een positief effect heeft op slaapkwaliteit, vermoeidheid en disfunctionele overtuigingen over slaap.13 Het ontwikkelen van kortere behandeltrajecten biedt voordelen voor de patiënt, en maakt de implementatie van slaapinterventies in de revalidatiebehandeling haalbaarder en toegankelijker.
Methode
Design
Dit onderzoek betreft een randomized controlled trial (RCT) en is geregistreerd bij het Overzicht van Medisch-wetenschappelijk Onderzoek in Nederland (OMON) met ID-nummer NL-OMON24225 (https://onderzoekmetmensen.nl/nl/trial/24225) en is goedgekeurd door de lokale wetenschapscommissie van Klimmendaal Revalidatiespecialisten.
Populatie en procedure
Patiënten werden geïncludeerd na indicatiestelling voor medisch specialistische revalidatiebehandeling voor aanhoudende pijn bij Klimmendaal door de revalidatiearts en psycholoog. Inclusiecriteria waren 1) zelf-gerapporteerde slapeloosheid (problemen met inslapen, doorslapen of te vroeg wakker worden) met impact op het dagelijks leven, 2) leeftijd tussen 18-75 jaar.
Exclusiecriteria waren 1) het starten met slaapmedicatie <4 weken geleden, 2) vastgestelde slaapstoornis, anders dan insomnie, 3) slaapproblemen worden verklaard door een psychiatrische stoornis, waarvoor specialistische behandeling is geïndiceerd (onder andere ernstige depressie, PTSS), 4) middelenmisbruik.
‘Problemen met inslapen,
doorslapen of te vroeg
wakker worden
Binnen de revalidatiebehandeling voor aanhoudende pijn kregen alle patiënten met slaapproblemen de aanvullende slaapmodule aangeboden, echter met behulp van randomisatie werd de timing hiervan bepaald (een wachtlijst controlegroep design). De slaapmodulegroep ontving direct na aanvang de slaapmodule als aanvulling op de reguliere revalidatiebehandeling. De controlegroep ontving eerst alleen reguliere revalidatiebehandeling, en kon na de nameting (>6 weken) starten met de slaapmodule. Randomisatie werd uitgevoerd door een onafhankelijke onderzoeker (niet betrokken bij inclusie of behandeling) met behulp van Research Randomizer (https://www.randomizer.org).
Vragenlijsten werden bij baseline en na 6 weken (einde slaapmodule) ingevuld ter evaluatie. Revalidanten gaven schriftelijke toestemming voor het gebruiken van de data voor wetenschappelijk onderzoek. Dataverzameling vond plaats tussen september 2018 en februari 2022. Op basis van een poweranalyse met behulp van G*Powerwerd een minimum van 42 deelnemers vastgesteld, bij een intraclass correlation coefficient (ICC) van 0,60, een iets kleiner dan medium effect size (f=0,20), een alfa van 0,05 en een power van 0,80.
Interventie
De revalidatieslaapmodule werd gegeven door een ergotherapeut of cognitief trainer, die getraind waren door een psycholoog in het geven van psycho-educatie over slaap en het veranderen van slaapgedrag. De slaapmodule bestaat uit vier face-to-face of online sessies (beeldbellen) van 60 minuten, aangeboden binnen een periode van zes weken. De inhoud van de slaapmodule is grotendeels gebaseerd op het CGT-i protocol voor de GGZ;14 echter is de huidige module korter en aangepast voor de revalidatiesetting. Tijdens de eerste sessie werden slaapproblemen geïnventariseerd middels een intake en een slaap-waakdagboek. Dit dagboek levert informatie op over diverse slaapparameters, waaronder tijd in bed, waaktijd, slaapduur en slaapkwaliteit, evenals nachtelijke activiteiten, cafeïne- en alcoholgebruik. De tweede sessie vond ongeveer een week na de eerste plaats. Tijdens deze sessie ontvingen patiënten psycho-educatie over slaap en kregen zij gepersonaliseerde slaapadviezen mee, waaronder slaaphygiëne adviezen, stimuluscontrole en milde slaaprestrictie. Stimuluscontrole richt zich op het versterken van de associatie tussen bed en slapen, terwijl slaaprestrictie, met een maximum van zeven tot acht uur bedtijd per nacht, bedoeld is om de slaapdruk te verhogen. Twee weken later volgde de derde sessie, waarin de slaapadviezen werden geëvalueerd en, indien nodig, aangepast of uitgebreid met ontspanningsoefeningen of piekeropdrachten. Tijdens de vierde en laatste sessie vond er een evaluatie plaats van de slaapproblemen en werd een terugvalpreventieplan opgesteld.
‘Deze CGT-I module is korter
en aangepast voor de
revalidatiesetting’
De slaapmodule was aanvullend op de reguliere revalidatiebehandeling voor aanhoudende pijn, die bestond uit een op maat gemaakt behandeltraject op basis van diagnostiek volgens het gevolgenmodel. Afhankelijk van de klachten en het in standhoudend patroon werden passende interventies geselecteerd, waaronder Graded Activity of Exposure. Slaap was geen standaardonderdeel van de reguliere behandeling. Wel was er structureel aandacht voor het activiteitenniveau overdag en werden op indicatie ontspanningsoefeningen gegeven, wat doorgaans ook onderdeel is van slaapinterventies, zoals CGT-i. De behandeltrajecten hadden een gemiddelde duur van 18 weken, met iedere 6 weken een evaluatiemoment.
Uitkomstmaten
In dit onderzoek werden verschillende zelfrapportage vragenlijsten gebruikt om de effecten van de interventie te evalueren. De primaire uitkomstmaat was slaapkwaliteit, die gemeten werd door middel van De Pittsburgh Sleep Quality Index (PSQI). De totaalscore geeft de ervaren slaapkwaliteit van de afgelopen maand weer, waarbij een hogere score correspondeert met meer slaapproblemen.15
Voor de secundaire uitkomstmaten werden verschillende zelfrapportagelijsten gebruikt. De Dutch Multi-Factor Fatigue Scale (DMFS) meet subjectieve vermoeidheid en omvat vijf subschalen: impact, gevolgen, fysieke en mentale vermoeidheid en de coping met vermoeidheid.16 De Hospital Anxiety and Depression Scale (HADS) werd ingezet om angst- en depressieve klachten te meten.17 Disfunctionele overtuigingen over slaap werden geëvalueerd met de Dysfunctional Beliefs and Attitudes about Sleep Scale (DBAS-16).18 Tot slot werd de Numeric Pain Rating Scale (NPRS) gebruikt om de gemiddelde pijnintensiteit te beoordelen van de afgelopen week op een schaal van 0 tot 10.
Data-analyse
IBM SPSS 30 werd gebruikt voor de statistische analyses. Demografische en baseline data werden vergeleken middels onafhankelijke t-toetsen. Voor geslacht werd een chi-kwadraat toets gebruikt. Om de effectiviteit van de slaapmodule te onderzoeken werden ‘per protocol’ analyses uitgevoerd. Een two-way Repeated Measures General Linear Model ANOVA (RM-ANOVA) werd uitgevoerd om de effecten van tijd en de tijd x groep interacties te meten voor alle uitkomstmaten. De between-subject factor was groep (slaapmodule versus controle) en de within subject-factor was tijd (voormeting versus nameting). Er werd een significantieniveau van p<0,05 gehanteerd voor alle analyses. Aanvullend werd de Reliable Change Index (RCI) berekend voor de PSQI volgens de methode van Jacobson en Truax.19 Hiermee kan worden vastgesteld hoeveel deelnemers een klinisch relevante vooruitgang laten zien.
Resultaten
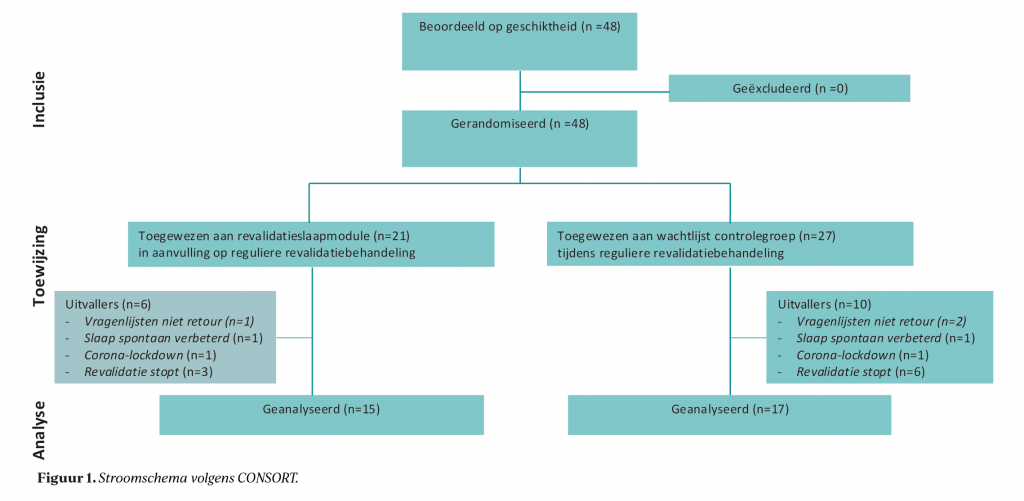
In totaal werden 48 deelnemers geïncludeerd, waarvan 32 personen de volledige procedure doorliepen met voor- en nameting. De dataverzameling vond deels plaats tijdens corona-lockdown periodes, waardoor een deel van de afspraken via beeldbellen verliepen en metingen per post werden opgestuurd. Dit heeft tot enkele extra uitvallers geleid. Figuur 1 bevat een CONSORT-diagram, waarin de voortgang van de deelnemers door de interventiefasen wordt weergegeven, inclusief redenen voor uitval.
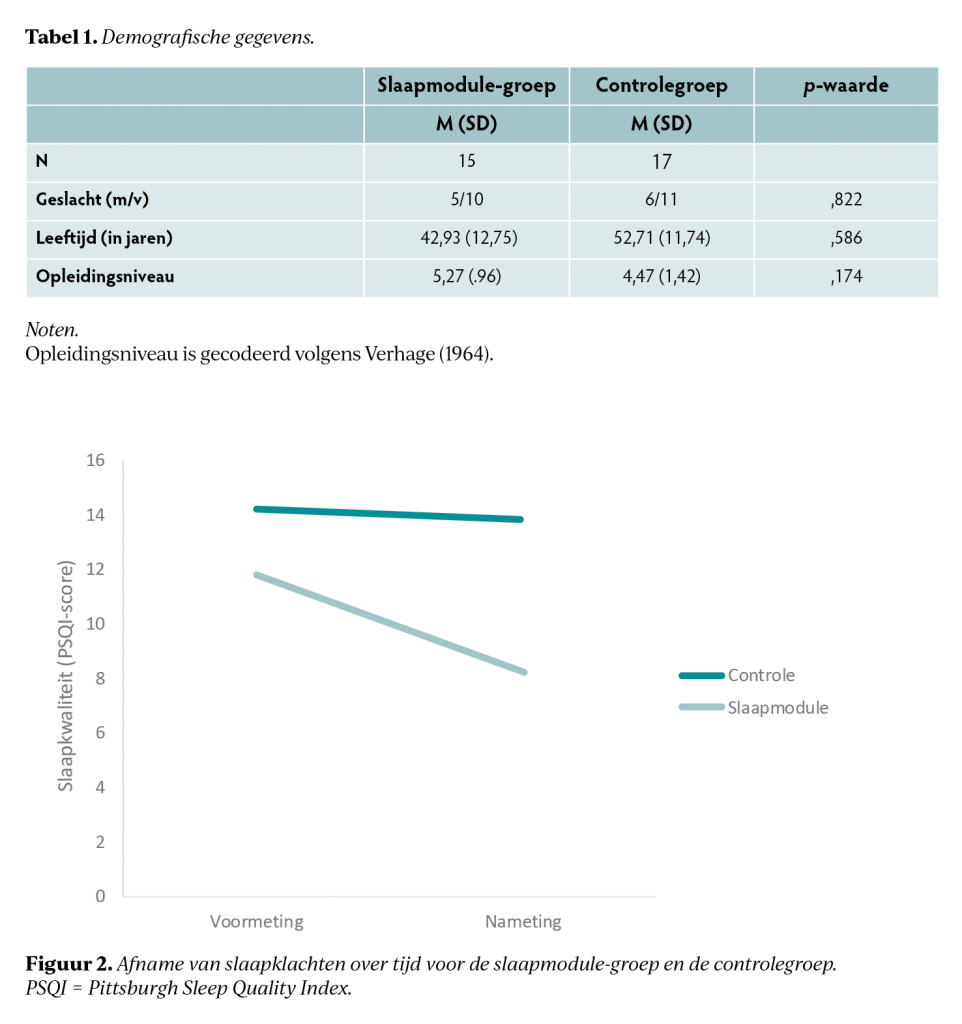
In tabel 1 worden de demografische kenmerken van de onderzoekspopulatie weergegeven. Er werd geen verschil gevonden tussen de groepen met betrekking tot leeftijd, geslacht en opleidingsniveau, evenals op de baseline metingen van alle uitkomstmaten.
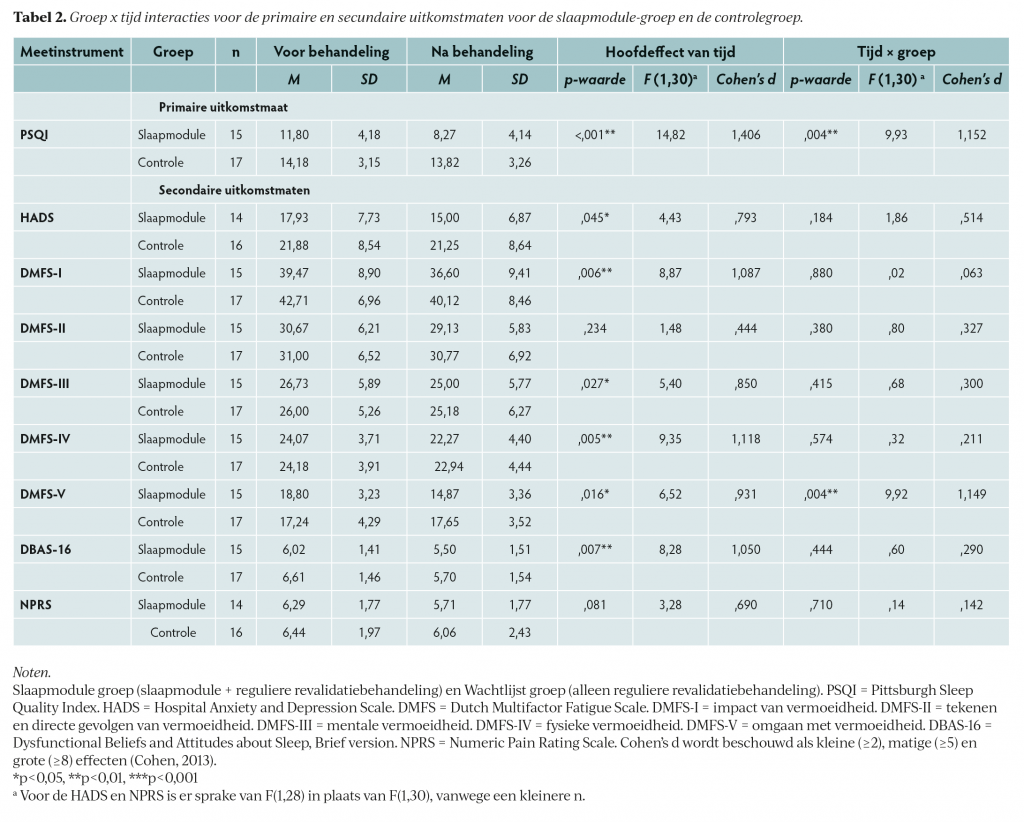
Tabel 2 toont alle voor- en nametingen met de resultaten van de RM-ANOVA-analyses. Voor de PSQI was er sprake van een significant hoofdeffect van tijd (p<,001) en een tijd x groep-interactie (p=,004), met een sterke effectgrootte. Dit betekent dat de slaapmodulegroep een sterkere verbetering liet zien in de slaapkwaliteit dan de controlegroep (figuur 2). Uit RCI-analyses blijkt dat binnen de slaapmodulegroep 53% een individuele significante verbetering rapporteerde op de PSQI, in vergelijking met 0% van de controlegroep.
Binnen de secundaire uitkomstmaten was er een significant hoofdeffect van tijd op de HADS (p=,045), maar geen significant interactie-effect (p=,184). Wanneer gekeken wordt naar de gemiddelde scores op de HADS en de matige effectsize van het interactie-effect, dan lijkt er sprake van een grotere afname van angst- en depressieve klachten in de slaapmodulegroep (Mverschil=2,93) dan in de controlegroep (Mverschil=0,63). Vermoedelijk werd het significantieniveau hier niet gehaald vanwege een te kleine power. Ten aanzien van de vermoeidheidsklachten werden significante hoofdeffecten van tijd gevonden voor de DMFS-subschalen ‘impact van vermoeidheid’ (p=,006), ‘mentale vermoeidheid’ (p=,027) en ’fysieke vermoeidheid’ (p=,005), wat aangeeft dat er voor beide groepen een verbetering optrad in mentale en fysieke vermoeidheidsklachten en in de impact daarvan op het dagelijks leven. Voor de subschaal ’omgaan met vermoeidheid’ is er een significant interactie-effect aanwezig (p=,004), wat aangeeft dat de slaapmodulegroep een grotere verbetering rapporteerde in het omgaan met vermoeidheid dan de wachtlijstgroep. Voor de DBAS-16 was er een significant tijd-effect (p=,007), wat impliceert dat de opvattingen over slaap in beiden groepen verbeterden. Er werd geen significant effect gevonden op de NPRS, de gemiddelde pijnscore van de afgelopen week.
Discussie
De huidige RCT laat zien dat het toevoegen van een kortdurende slaapmodule aan de revalidatiebehandeling van mensen met aanhoudende pijn en slapeloosheid kan leiden tot het verbeteren van de slaapkwaliteit en het beter omgaan met vermoeidheidsklachten. Daarnaast waren er statistisch positieve veranderingen in angst- en stemmingsklachten en vermoeidheidsklachten over tijd voor beide groepen, vermoedelijk het gevolg van de reguliere revalidatiebehandeling. De verbetering in slaapkwaliteit is in lijn met eerder onderzoek naar CGT-i bij aanhoudende pijn.10,20 Relevant gegeven is dat, in vergelijking met andere studies, de huidige pijnrevalidatiepopulatie hogere pijnscores en een hogere mate van slapeloosheid rapporteerde tijdens de voormeting. Desondanks is er in deze populatie sprake van een significante verbetering in slaapkwaliteit bij 53% van de mensen middels de inzet van een kortere slaapmodule dan in andere studies. Er werd overeenkomstig met eerder onderzoek geen effect gevonden van de slaapmodule op de pijnklachten zelf. 10 Vanwege de complexiteit van aanhoudende pijn en wisselwerking met verschillende factoren is vermoedelijk een gerichte intensieve revalidatiebehandeling van meer dan zes weken nodig om pijnvermindering te realiseren.21
‘Een goede aanvulling op
bestaande revalidatiebehandeling’
De bevindingen komen tevens overeen met de effectiviteit van de revalidatieslaapmodule bij patiënten met hersenletsel.13 Dit suggereert dat een kortdurende slaapmodule effectief is bij verschillende patiëntgroepen en een goede aanvulling vormt op bestaande revalidatieprogramma’s. Een sterkte van deze module is bovendien de praktische toepasbaarheid; de module bestaat uit slechts vier sessies, is gedeeltelijk of geheel online uitvoerbaar en kan gegeven worden door ergotherapeuten.
De belangrijkste beperking van de studie is dat de steekproef relatief klein was en de gewenste power daardoor niet is gehaald. Daarmee samenhangend was de drop-out relatief hoog. Hoewel de reden voor drop-out voornamelijk bestond uit het stoppen met de gehele revalidatiebehandeling, heeft de corona-lockdown voor extra drop-outs en missing-data gezorgd. Er zijn geen aanwijzingen dat het slaapmodule-onderzoek specifiek heeft geleid tot een hogere drop-out. Zowel de te kleine steekproef als de hoge mate van drop-out kunnen de richting en sterkte van de effecten hebben beïnvloed. Daarnaast is er behoefte aan follow-up-metingen om te onderzoeken in hoeverre de gevonden resultaten behouden blijven op langere termijn en in hoeverre de slaapmodule ook bijdraagt aan betere behandeluitkomsten op activiteiten- en participatieniveau. Tot slot zou vervolgonderzoek naar het moment van toepassen van de slaapmodule binnen de revalidatiebehandeling waardevol zijn. In huidig onderzoek werd de slaapmodule uitgevoerd aan de start van de interdisciplinaire behandeling, gelijktijdig met andere interventies. Te onderzoeken valt welke impact de toepassing van de slaapmodule voorafgaand aan de revalidatiebehandeling zou hebben op de effectiviteit van de algehele behandeling.
Concluderend lijkt de slaapmodule van meerwaarde in de revalidatiebehandeling voor aanhoudende pijn, met verbeteringen in slaapkwaliteit en de omgang met vermoeidheidsklachten. Vervolgonderzoek is nodig om te onderzoeken in hoeverre de verbeteringen op langere termijn behouden blijven. Voor de klinische praktijk wordt geadviseerd om insomnie mee te behandelen tijdens de revalidatie, waarbij de inzet van de revalidatieslaapmodule een laagdrempelige interventiemogelijkheid is.
Abstract
Background: Sleep disturbances, particularly insomnia, are highly prevalent among individuals with chronic pain and significantly impact quality of life and psychosocial functioning. Despite evidence supporting Cognitive Behavioral Therapy for Insomnia (CBT-I), its integration into standard interdisciplinary rehabilitation programs is limited due to time and resource constraints.
Objective: This study aimed to evaluate the effectiveness of a brief, protocolled sleep intervention, integrating core elements of CBT-I, when added to usual care in a rehabilitation setting for patients with chronic pain and comorbid sleep disturbances.
Methods: In this randomized controlled trial (RCT), patients were allocated to either an immediate sleep module group (n=21) or a waitlist control group (n=27). The intervention consisted of four weekly sessions over six weeks and was delivered by occupational therapists. Primary outcome was sleep quality, assessed using the Pittsburgh Sleep Quality Index (PSQI). Secondary outcomes included fatigue, dysfunctional beliefs about sleep, anxiety, depression, and pain. Pre- and post-intervention measures were analyzed using repeated measures ANOVA and Reliable Change Index (RCI).
Results: Thirty-two participants completed both assessments. The sleep module group showed a significantly greater improvement in sleep quality compared to the control group (p = .004; 53% vs. 0% reliable improvement). Positive effects were also observed in coping with fatigue, though no changes were found in pain intensity.
Conclusion: This brief sleep module is a feasible and effective addition to interdisciplinary rehabilitation for chronic pain, particularly for improving sleep quality. Further research is needed to assess long-term outcomes and generalizability.
Referenties
- Finan PH, Buenaver LF, Runko VT, Smith MT. Cognitive-behavioral therapy for comorbid insomnia and chronic pain. Sleep Medicine Clinics 2014;9(2):261–74. https://doi.org/10.1016/j.jsmc.2014.02.007
- Dragioti E, Bernfort L, Larsson B, Gerdle B, Levin LÅ. Association of insomnia severity with well-being, quality of life and health care costs: A cross-sectional study in older adults with chronic pain (PainS65+). European Journal of Pain. 2018;22(2):414-425. https://doi.org/10.1002/ejp.1130
- Van Looveren E, Bilterys T, Munneke W, Cagnie B, Ickmans K, Mairesse O, Malfliet A, De Baets L, Nijs J, Goubert D, Danneels L, Moens M, Meeus M. The Association between Sleep and Chronic Spinal Pain: A Systematic Review from the Last Decade. Journal of Clinical Medicine. 2021;10(17):3836. https://doi.org/10.3390/jcm10173836
- Vitiello MV, McCurry SM, Shortreed SM, Baker LD, Rybarczyk BD, Keefe FJ, von Korff M. Short-term improvement in insomnia symptoms predicts long-term improvements in sleep, pain, and fatigue in older adults with comorbid osteoarthritis and insomnia. Pain 2014;155(8):1547–54. https://doi.org/10.1016/j.pain.2014.04.032
- Johnson EO, Roth T, Breslau N. The association of insomnia with anxiety disorders and depression: Exploration of the direction of risk. Journal of Psychiatric Research 2006;40(8):700–8. https://doi.org/10.1016/j.jpsychires.2006.07.008
- Finan PH, Smith MT. The comorbidity of insomnia, chronic pain, and depression: Dopamine as a putative mechanism. Sleep Medicine Reviews 2013;17(3):173–83. https://doi.org/10.1016/j.smrv.2012.03.003
- Finan PH, Goodin BR, Smith MT. The association of sleep and pain: An update and a path forward. The Journal of Pain 2013;14(12):1539–52. https://doi.org/10.1016/j.jpain.2013.08.007
- Climent-Sanz C, Valenzuela-Pascual F, Martínez-Navarro O, Blanco-Blanco J, Rubí-Carnacea F, García-Martínez E, Soler-González J, Barallat-Gimeno E, Gea-Sánchez M. Cognitive behavioral therapy for insomnia (CBT-i) in patients with fibromyalgia: a systematic review and meta-analysis. Disability and Rehabilitation. 2022;44(20):5770-5783. https://doi.org/10.1080/09638288.2021.1954706.
- Jungquist CR, Tra Y, Smith MT, Pigeon WR, Matteson-Rusby S, Xia Y, Perlis ML. The durability of cognitive behavioral therapy for insomnia in patients with chronic pain. Sleep Disorders 2012:1–8. https://doi.org/10.1155/2012/679648
- Malfliet A, de Baets L, Bilterys T, van Looveren E, Mairesse O, Cagnie B, Meeus M, Moens M, Goubert D, Munneke W, Daneels L, Ickmans K, Kamper S, Nijs J. Cognitive behavioral therapy for insomnia in pain management for nonspecific chronic spinal pain: A randomized clinical trial. JAMA Network Open 2024;7(8):e2425856. https://doi.org/10.1001/jamanetworkopen.2024.25856
- Tang NKY, Lereya ST, Boulton H, Miller MA, Wolke D, Cappuccio FP. Nonpharmacological treatments of insomnia for long-term painful conditions: A systematic review and meta-analysis of patient-reported outcomes in randomized controlled trials. Sleep 2015;38(11):1751–64. https://doi.org/10.5665/sleep.5158
- Vitiello MV, McCurry SM, Shortreed SM, Baker LD, Rybarczyk BD, Keefe FJ, von Korff M. Short-term improvement in insomnia symptoms predicts long-term improvements in sleep, pain, and fatigue in older adults with comorbid osteoarthritis and insomnia. Pain 2014;155(8):1547–54. https://doi.org/10.1016/j.pain.2014.04.032
- Pilon L, Frankenmolen NF, van der Zijp J, Kessels RPC, Bertens D. A short add-on sleep intervention in the rehabilitation of individuals with acquired brain injury: A randomized controlled trial. NeuroRehabilitation 2013;53(3):323–34. https://doi.org/10.3233/NRE-230139
- Verbeek I, van de Laar M. Behandeling van langdurige slapeloosheid. In: Pijnenborg M, Scholten W, red. Protocollen in de GGZ. Bohn Stafleu van Loghum, 2015.
- Buysse DJ, Reynolds CF, Monk TH, Berman SR, Kupfer DJ. The Pittsburgh Sleep Quality Index: A new instrument for psychiatric practice and research. Psychiatry Research 1989;28(2):193–213. https://doi.org/10.1016/0165-1781(89)90047-4
- Visser-Keizer AC, Hogenkamp A, Westerhof-Evers HJ, Egberink IJL, Spikman JM. Dutch Multifactor Fatigue Scale: A new scale to measure the different aspects of fatigue after acquired brain injury. Archives of Physical Medicine and Rehabilitation 2015;96(6):1056–63. https://doi.org/10.1016/j.apmr.2014.12.010
- Zigmond AS, Snaith RP. The Hospital Anxiety and Depression Scale. Acta Psychiatrica Scandinavica 1983;67(6):361–70. https://doi.org/10.1111/j.1600-0447.1983.tb09716.x
- Morin CM. Insomnia: Psychological assessment and management. 1993, Guilford Press.
- Jacobson NS, Truax P. Clinical significance: A statistical approach to defining meaningful change in psychotherapy research. Journal of Consulting and Clinical Psychology 1991;59(1):12–9. https://doi.org/10.1037/0022-006x.59.1.12
- Jungquist CR, O’Brien C, Matteson-Rusby S, Smith MT, Pigeon WR, Xia Y, Perlis ML. The efficacy of cognitive-behavioral therapy for insomnia in patients with chronic pain. Sleep Medicine 2010;11(3):302–9. https://doi.org/10.1016/j.sleep.2009.05.018
- VRA. Richtlijn Chronische Pijnrevalidatie, 2024. Richtlijnendatabase Federatie Medisch Specialisten.
Keywords: chronic pain, sleep, CBT-I, rehabilitation
Trefwoorden: aanhoudende pijn, slaap, CGT-I, revalidatie
Gerelateerde artikelen NTR

Hoge prevalentie slapeloosheid bij hersenletsel vraagt om effectieve behandeling

Slaapapneu: diagnostiek en behandeling in eigen handen bij patiënten met een dwarslaesie

Slaapstoornissen en management bij de ziekte van Parkinson

De effectiviteit van een slaapmodule als aanvulling op de revalidatiebehandeling voor aanhoudende pijn
Gerelateerde artikelen Revalidatie Magazine

‘Het blijft voor professionals een lastig onderwerp’

Zo brengen we e-revalidatie naar volgend niveau

Zoek de verschillen! Zo kun je de vele nieuwe loopsystemen het beste gebruiken


