Nociceptieve of neuropathische pijn bij patiënten met een dwarslaesie
Wetenschappelijke publicatie
Pijn is een van de meest frequente en ernstige secundaire problemen bij mensen met een dwarslaesie. Het behandelen van nociceptieve en neuropathische pijn bestaat tijdens de klinische revalidatiefase vooral uit medicamenteuze behandeling. In dit onderzoek evalueren wij aan de hand van de geldende richtlijnen het voorschrijven van pijnmedicatie bij klinische patiënten met een dwarslaesie in De Hoogstraat Revalidatie.
Auteurs
DRS. D. (DANIËL) UITTENBOGAARD
Aios revalidatiegeneeskunde, De Hoogstraat Revalidatie, Utrecht (inmiddels revalidatiearts Meander Medisch Centrum, Amersfoort)
DR. T.C. (TIM) CRUL
Revalidatiearts, afdeling Revalidatiegeneeskunde Radboudumc Nijmegen
PROF. DR. M.W.M. (MARCEL) POST
Senior onderzoeker, Kenniscentrum Revalidatiegeneeskunde Utrecht, UMC Utrecht Hersencentrum, UMC Utrecht en De Hoogstraat Revalidatie, Utrecht; hoogleraar revalidatiegeneeskunde, Rijksuniversiteit Groningen, UMC Groningen, Centrum voor Revalidatie, Groningen
DR. J. ( JANNEKE) STOLWIJK-SWÜSTE
Revalidatiearts, afdeling Revalidatie, Fysiotherapiewetenschap en Sport, UMC Utrecht, Kenniscentrum Revalidatiegeneeskunde Utrecht
Een dwarslaesie is een complexe aandoening die ontstaat na een beschadiging van het ruggenmerg. Dit kan leiden tot sensorische disfunctie, motorische disfunctie en secundaire stoornissen.1,2 Pijn is met een prevalentie van 68% een veelvoorkomende secundaire stoornis en wordt volgens de International Spinal Cord Injury Pain Classification (ISCIP) ingedeeld in nociceptieve pijn, neuropathische pijn, overige pijn, en onbekende pijn.3,4
De primaire behandeling van neuropathische pijn bij een dwarslaesie is medicamenteus.5 De behandeling van pijn is echter moeizaam en het bewijs beperkt.6 Het meeste bewijs voor effectiviteit bestaat voor gabapentine, pregabaline (anticonvulsiva) en amitriptyline (antidepressivum).7 Onderzoek suggereert dat amitriptyline de voorkeur heeft bij patiënten met neuropathische pijn en depressieve kenmerken.5,7 Verder kunnen intraveneuze opioïden kortdurend effect geven.8 Voor de orale opioïden tramadol en oxycodon is het bewijs matig.7,8
‘Het is onduidelijk of de genoemde
richtlijnen in de praktijk
worden gevolgd’
Systematische reviews over medicatie bij neuropathische pijn in dwarslaesiepatiënten tonen meestal studies van matige kwaliteit.7,8 Daarentegen toont een bredere review, naar het effect van medicatie bij neuropathische pijn ongeacht etiologie, sterk bewijs voor de behandeling met pregabaline, gabapentine, duloxetine, venlafaxine en tricylische antidepressiva.9 Desondanks blijft het opstellen van een optimaal behandelbeleid voor specifieke groepen zoals dwarslaesiepatiënten uitdagend.8,9 De richtlijn Dwarslaesierevalidatie (2017) biedt hiervoor wel handvatten en een behandelschema, zie figuur 1. Voor de medicamenteuze behandeling van nociceptieve pijn wordt veel gebruik gemaakt van de WHO-pijnladder.10 Deze pijnladder werd in 1986 gepubliceerd voor oncologisch gerelateerde pijn, maar wordt nu ook toegepast in richtlijnen voor acute nociceptieve pijn.11,12 De toepassing bij niet-oncologische pijn heeft echter ook een keerzijde, zo draagt het bij aan het toenemend gebruik van opioïden.13
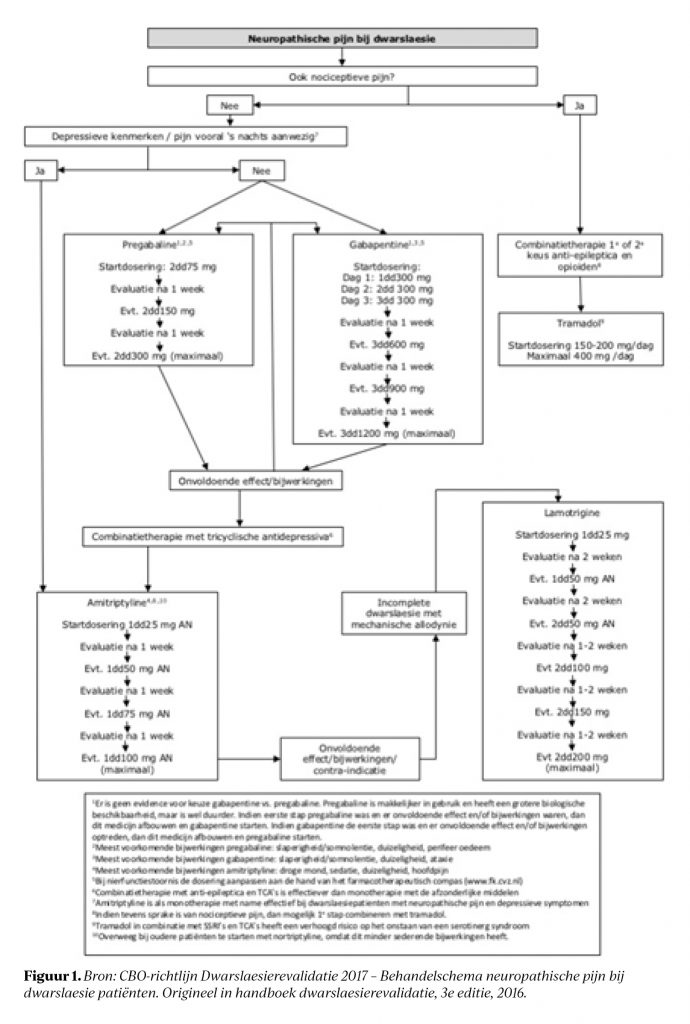
Het is onduidelijk of de genoemde richtlijnen in de praktijk worden gevolgd. Er liggen hier mogelijk kansen om de pijnbehandeling te optimaliseren. Dit onderzoek inventariseert in hoeverre de richtlijn Dwarslaesierevalidatie en de WHO-pijnladder worden toegepast in De Hoogstraat bij pijnbehandeling bij mensen met een dwarslaesie.
Patiënten en methode
Een retrospectief statusonderzoek werd uitgevoerd. Aan de hand van de Nederlandse Dataset Dwarslaesierevalidatie (NDD) zijn alle in 2021 opgenomen patiënten met een recente dwarslaesie en pijn geïdentificeerd. Patiënten werden geëxcludeerd als zij geen pijn hadden bij opname of bij ontslag uit het revalidatiecentrum, bekend waren met chronische pijn vóór het ontstaan van de dwarslaesie, jonger waren dan 18 jaar, of expliciet bezwaar hadden gemaakt tegen het gebruik van hun medische gegevens voor wetenschappelijk onderzoek. Patiënten werden geïncludeerd op volgorde van opnamedatum totdat het aantal van 50 patiënten bereikt werd. Verschillende demografische karakteristieken, letselkarakteristieken, type pijn, type pijnbehandeling, details rond medicatiegebruik, behandelend revalidatiearts, bijwerkingen van pijnmedicatie, naleving van richtlijnen en reden van afwijken werden uit het elektronische patiëntendossier verzameld. Nociceptieve en neuropathische pijn is vastgesteld op basis van vragen die gedefinieerd zijn in Spinal Cord Injury Pain Basic Data Set en vervolgens zijn overgenomen in de NDD.14

Resultaten
Van de 113 gescreende patiënten werden er 50 geïncludeerd, zie tabel 1. Ongeveer de helft was man en de gemiddelde leeftijd was 56 jaar. Circa de helft had een niet-traumatische dwarslaesie en de meerderheid had een incomplete dwarslaesie, ASIA Impairment Scale (AIS) D. Een incomplete dwarslaesie waarbij minstens de helft van de testspieren onder het dwarslaesieniveau een kracht graad 3 of hoger had. Pijnmedicatie werd voorgeschreven bij alle patiënten en een derde onderging ook fysiotherapeutische pijnbehandeling, zoals specifieke oefentherapie gericht op adequate belasting van spieren en gewrichten. Bij acht patiënten werden direct bij opname in De Hoogstraat medicatiewijzigingen aangebracht.

Nociceptieve pijn
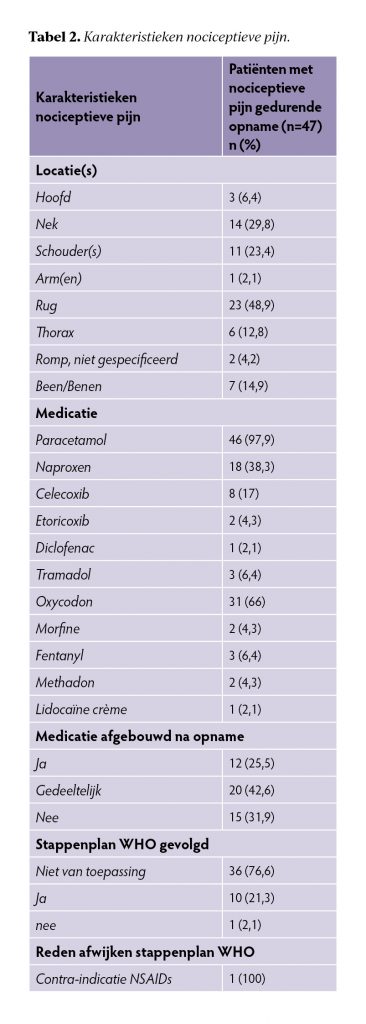
Karakteristieken van de patiënten met nociceptieve pijn zijn terug te vinden in tabel 2. De locatie van nociceptieve pijn betrof in 49% de rug. De pijnmedicatie werd bij opname in het revalidatiecentrum overgenomen van het verwijzend ziekenhuis. Bij 92% van de patiënten werd paracetamol voorgeschreven en bij 66% oxycodon. Dit daalde respectievelijk naar 68% en 28% bij ontslag uit het revalidatiecentrum. Ruim twee derde van de patiënten met oxycodon bij ontslag was nog bezig met een afbouwtraject hiervan. Binnen deze groep had 53% een traumatische etiologie met een klinische opnameduur van 25 tot 133 dagen met een mediaan van 48 dagen.
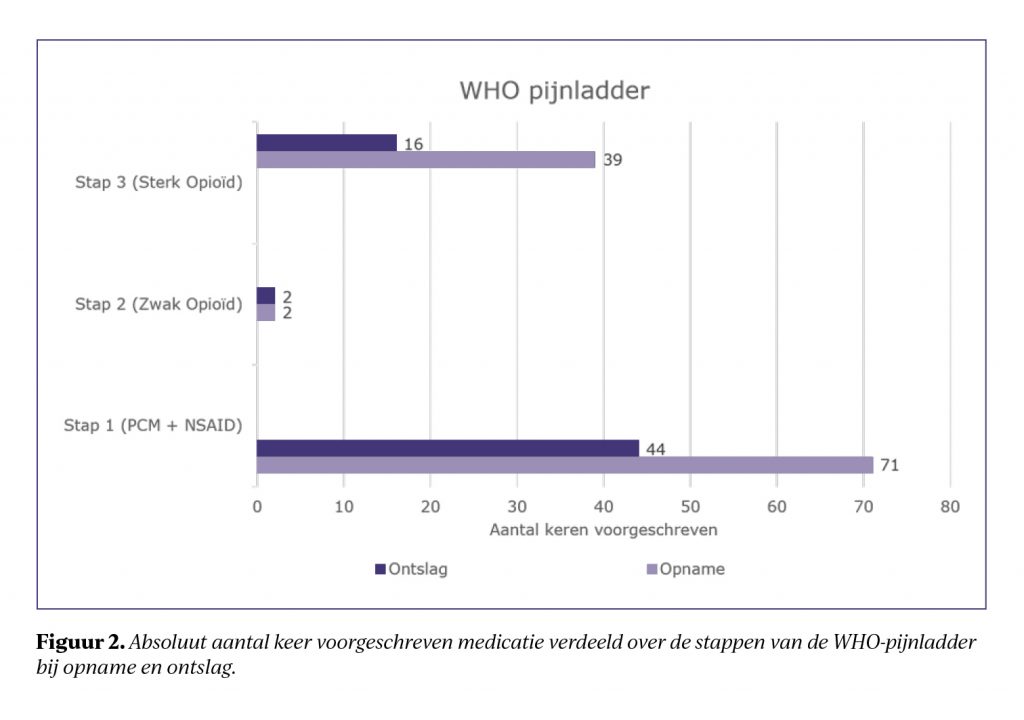
Figuur 2 toont de afname in het voorschrijven van paracetamol en oxycodon per stap in de WHO-pijnladder bij opname en ontslag. Bij 23% van de patiënten werd nociceptieve pijnmedicatie opgebouwd, hierbij werd in 91% de WHO-pijnladder gevolgd en in 9% is hiervan afgeweken. Er is afgeweken van de WHO-pijnladder vanwege een contra-indicatie voor het geven van een NSAID. Bij de overige 77% van de patiënten bleef het medicatiegebruik gelijk of werd dit afgebouwd.
Neuropathische pijn
Karakteristieken van de patiënten met neuropathische pijn en voorgeschreven medicatie zijn terug te vinden in tabel 3. Bij 77% van de patiënten bevond de locatie van de pijn zich onder het niveau van de dwarslaesie. Pregabaline was het meest voorgeschreven medicijn gedurende de gehele opname met 75%, gevolgd door amitriptyline met 64%. Bij opname gebruikte 52% van de patiënten pregabaline en bij ontslag 48%. Voor amitriptyline was dit 24% bij opname en 40% bij ontslag. Ook werden er medicamenten voorgeschreven die niet in de richtlijn Dwarslaesierevalidatie staan beschreven, zoals carbamazepine, capsaïcine- en amitriptylinecrème.
‘Bij 92% van de patiënten werd
paracetamol voorgeschreven
en bij 66% oxycodon’
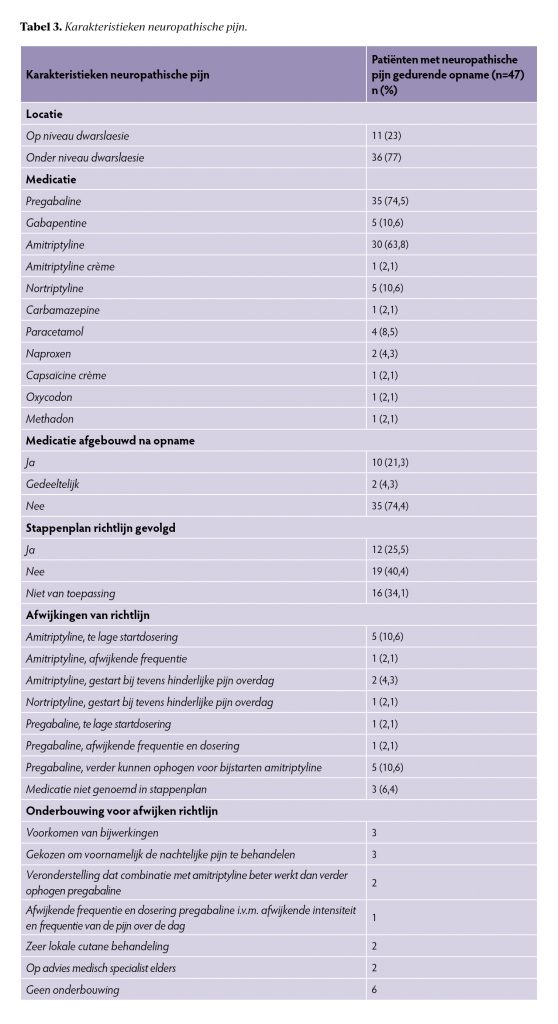
De richtlijn Dwarslaesierevalidatie werd bij 26% van de patiënten gevolgd en bij 40% niet. In de overige situaties was de richtlijn niet van toepassing vanwege onveranderde of afgebouwde dosering. De meest voorkomende afwijkingen van de richtlijn bestonden uit het voorschrijven van een lagere startdosering dan geadviseerd of het toevoegen van een ander medicijn terwijl de dosering van het huidige medicijn eerst verhoogd had dienen te worden. Redenen voor afwijking werden beschreven in 13 van de 19 gevallen en bestonden onder andere uit ‘het verminderen van bijwerkingen’, ‘op advies van medisch specialist elders’ of ‘keuze voor zeer lokale behandeling’. Verder werd bij drie patiënten beschreven dat er specifiek was gekozen om alleen pijn in de nacht te behandelen, terwijl er ook pijn overdag was. Daarnaast werd er twee keer gekozen om eerder een ander medicijn erbij te starten. De vooronderstelling was dat dit meer effect zou opleveren dan ophoging van het huidige medicijn. Ook werd bij één patiënt een afwijkende frequentie en dosering gedurende de dag gekozen, omdat de pijn op specifieke momenten van de dag fluctueerde.
Discussie
De resultaten laten zien dat de WHO-pijnladder binnen deze patiëntengroep adequaat wordt toegepast. Opvallend is dat nociceptieve pijnmedicatie tijdens de revalidatie vaak wordt afgebouwd, wat mogelijk samenhangt met factoren zoals weefselherstel, toename in mobiliteit en het verkrijgen van meer zelfregie. Naproxen is de meest voorgeschreven NSAID. Dit is de NSAID van voorkeur binnen De Hoogstraat vanwege het lagere risico op cardiovasculaire bijwerkingen. Daarnaast wordt tramadol weinig voorgeschreven, mogelijk doordat deze stap in het ziekenhuis is geprobeerd of is overgeslagen, mede gezien het hoge percentage oxycodongebruikers bij opname in het revalidatiecentrum.
Bij neuropathische pijn wordt de richtlijn Dwarslaesierevalidatie regelmatig niet gevolgd, vooral bij het voorschrijven van amitriptyline en pregabaline. De richtlijn adviseert een startdosering van 25mg amitriptyline, maar in de praktijk wordt vaak een lagere dosering van 10 tot 25mg voorgeschreven om bijwerkingen te verminderen, conform de NHG-standaard en het Farmacotherapeutisch Kompas.11,16 Deze aanbeveling bestond al op moment van publicatie van de richtlijn Dwarslaesierevalidatie.17 De richtlijn vermeldt niet specifiek waarom 25mg wordt aanbevolen, maar de gerefereerde studie in de tekst beschrijft een startdosering van 25mg.5
Verder wordt pregabaline vaak niet opgehoogd tot de maximale dosering, in plaats daarvan wordt amitriptyline toegevoegd. Een enkele keer is in de status vermeld dat dit mogelijk meer effect zou opleveren, verdere onderbouwing ontbreekt. De overweging kan zijn geweest om eerder naar een ander middel over te stappen om bijwerkingen te verminderen zonder dit in de status te vermelden. Gabapentine, die in de richtlijn wordt beschreven als een alternatief voor pregabaline, wordt in De Hoogstraat weinig voorgeschreven, waarschijnlijk door voorkeuren van voorschrijvers. Het is onduidelijk of afwijkingen van de richtlijnen leiden tot betere of slechtere zorg, direct vergelijkend onderzoek ontbreekt. Er is echter wel onderzoek die voorkeur laat zien voor gabapentine als het gaat om het verminderen van bijwerkingen.18
Naast medicatie speelt niet-medicamenteuze behandeling een belangrijke rol.5,6,19 In dit onderzoek werd fysiotherapie regelmatig beschreven voor adviezen in houding en beweging. De niet-medicamenteuze interventies worden echter beperkt gedocumenteerd in het patiëntendossier, waardoor de lijst met behandelingen onvolledig kan zijn.
‘De richtlijn adviseert een startdosering van
25mg amitriptyline, in de praktijk wordt vaak
een lagere dosering voorgeschreven’
Dit onderzoek biedt inzicht in medicatiegebruik binnen één revalidatiecentrum, maar de resultaten kunnen niet zo maar naar andere centra worden gegeneraliseerd. Verder stamt de richtlijn Dwarslaesierevalidatie uit 2017. Een aanbeveling voor herziening is op zijn plaats. Er zijn nieuwe onderzoeken beschikbaar, zoals bijvoorbeeld te zien is in een Canadese richtlijn uit 2021 over neuropathische pijn na een dwarslaesie. Ons onderzoek toont behoefte aan advies over afbouw van pijnmedicatie en aan onderzoek naar de effectiviteit van gecombineerde behandeling bij nociceptieve en neuropathische pijn.
Conclusie
Deze studie onderzoekt in hoeverre de richtlijn Dwarslaesierevalidatie en de WHO-pijnladder worden gevolgd bij medicamenteuze pijnbehandeling bij mensen met een dwarslaesie. De WHO-pijnladder is bij vrijwel alle patiënten gevolgd met nociceptieve pijn, hoewel ook duidelijk is geworden dat pijnmedicatie bij nociceptieve pijn vooral wordt afgebouwd. De richtlijn Dwarslaesierevalidatie voor neuropathische pijn werd bij 26% van de patiënten gevolgd en in 40% van de patiënten niet gevolgd. Het betreft hier voornamelijk afwijkingen bij het voorschrijven van amitriptyline en pregabaline.
De uitkomsten laten zien dat er ruimte is om het medicatiebeleid te optimaliseren, maar ook dat de huidige richtlijn Dwarslaesierevalidatie niet voorziet in alle vragen en toe is aan een update.
Abstract
Introduction: Pain is a frequent secondary health condition among individuals with spinal cord injury (SCI), impacting quality of life and presenting treatment challenges. This study examines adherence to pain management guidelines at the inpatient SCI Department of De Hoogstraat Rehabilitation.
Methods: Data was collected on 50 inpatients with recent SCI and pain admitted in 2021, excluding those with pre-existing pain.
Results: Of the 50 patients, 46% had traumatic SCI, 60% ASIA Impairment Scale D, and 54% paraplegia. At admission, 94% had nociceptive pain, with 92% receiving paracetamol and 66% oxycodone, which decreased to 68% and 28%, respectively, at discharge. The WHO guideline for nociceptive pain was inapplicable in 77% of cases due to drug tapering and non-adherence was only 2%.
At admission, 72% of patients had neuropathic pain. Pregabalin use declined from 52% to 48%, while amitriptyline use increased from 24% to 48%. The Dutch guideline for treating neuropathic pain in SCI patients was followed in 26%, not followed in 40% and inapplicable in 34%. Reasons for deviation were described in 13 of 19 cases.
Conclusion: The WHO guideline for nociceptive pain was largely inapplicable due to drug tapering. For neuropathic pain, adherence was low, indicating potential for optimization in prescribing practices and guidelines.
Keywords: spinal cord injury, pain, guideline
Referenties
- Rupp R. Spinal cord lesions. Handb Clin Neurol 2020;168:51-65.
- Adriaansen J, Ruijs L, Koppenhagen C, Asbeck F, Snoek G, Kuppevelt D, et al. Secondary health conditions and quality of life in persons living with spinal cord injury for at least ten years. Journal of Rehabilitation Medicine 2016;48(10):853–60.
- Bryce TN, Biering-Sørensen F, Finnerup NB, Cardenas DD, Defrin R, Lundeberg T, et al. International Spinal Cord Injury Pain Classification: part I. Background and description. Spinal Cord 2012;50(6):413–7.
- Hunt C, Moman R, Peterson A, Wilson R, Covington S, Mustafa R, et al. Prevalence of chronic pain after spinal cord injury: a systematic review and meta-analysis. Regional Anesthesia & Pain Medicine 2021;46(4):328–36.
- Kwaliteitsinstituut voor de Gezondheidszorg, CBO richtlijn Dwarslaesierevalidatie 2017.
- Stolwijk-Swüste JM, van Laake–Geelen CCM. Neuropathische pijn bij dwarslaesie: een therapeutische uitdaging. Ned Tijdschr Revalidatiegeneeskd 2019;41(3):8-10.
- Loh E, Mirkowski M, Agudelo AR, Allison DJ, Benton B, Bryce TN, et al. The CanPain SCI clinical practice guidelines for rehabilitation management of neuropathic pain after spinal cord injury: 2021 update. Spinal Cord 2022;60(6):548-66.
- Mehta S, McIntyre A, Janzen S, Loh E, Teasell R. Systematic Review of Pharmacologic Treatments of Pain After Spinal Cord Injury: An Update. Archives of Physical Medicine and Rehabilitation 2016;97(8):1381-91.e1.
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin Rhet al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol 2015;14(2):162-73.
- WHO. Cancer pain relief (1986). World Health Organization.
- Nederlands Huisartsen Genootschap. NHG standaard Pijn, juni 2018, laatste aanpassing september 2024.
- Kwaliteitsinstituut voor de Gezondheidszorg, CBO richtlijn Post operatieve pijn 2023.
- Ballantyne JC, Kalso E, Stannard C. WHO analgesic ladder: a good concept gone astray. BMJ 2016;352:i20.
- Widerström-Noga E, Biering-Sørensen F, Bryce TN, Cardenas DD, Finnerup NB, Jensen MP, et al. The International Spinal Cord Injury Pain Basic Data Set (version 2.0). Spinal Cord 2014;52(4):282-6.
- Kwaliteitsinstituut voor de Gezondheidszorg, CBO richtlijn, Generieke richtlijnmodule gepast opioïdengebruik 2022.
- Zorginstituut Nederland (ZIN). Farmacotherapeutisch Kompas. Geneesmiddelen, amitriptyline, tricyclische antidepressiva, N06AA09. https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/a/amitriptyline Bezocht 5-12-2023.
- Zorginstituut Nederland (ZIN). Farmacotherapeutisch Kompas. Geneesmiddelen, amitriptyline, tricyclische antidepressiva. 2017. Geverifieerd middels email correspondentie met ZIN, email op aanvraag beschikbaar.
- Tong C, Zhengyao Z, Mei L, Dongpo S, Qian H, Fengqun M. Pregabalin and Gabapentin in Patients with Spinal Cord Injury-Related Neuropathic Pain: A Network Meta-Analysis. Pain Ther 2021;10(2):1497-509.
- Boldt I, Eriks-Hoogland I, Brinkhof MW, de Bie R, Joggi D, von Elm E. Non-pharmacological interventions for chronic pain in people with spinal cord injury. Cochrane Database of Systematic Reviews 2014;2014(11).
Trefwoorden: dwarslaesie, pijn, richtlijn
Gerelateerde artikelen NTR

Medicatie-ontwikkelingen voor Duchenne spierdystrofie

Sta stil bij iedere pil: polyfarmacie en niet-aangeboren hersenletsel
Fighting the Phantom, medicamenteuze behandeling van fantoompijn

Evaluatie van voorgeschreven pijnmedicatie tijdens klinische revalidatie
Gerelateerde artikelen Revalidatie Magazine

Kinderrevalidatie leuker maken

Sneller herstel door vroege revalidatie

Continuïteit en veiligheid na een grote verandering


